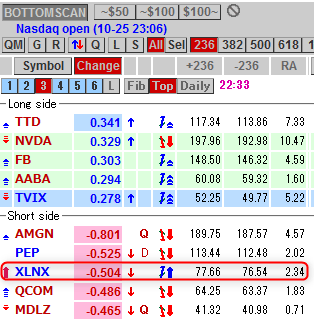
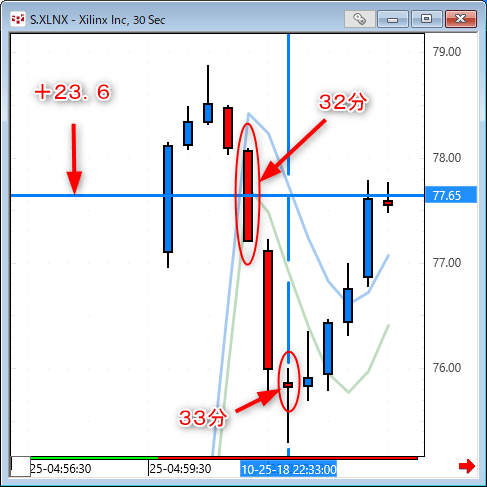
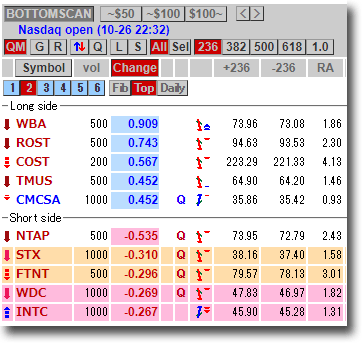
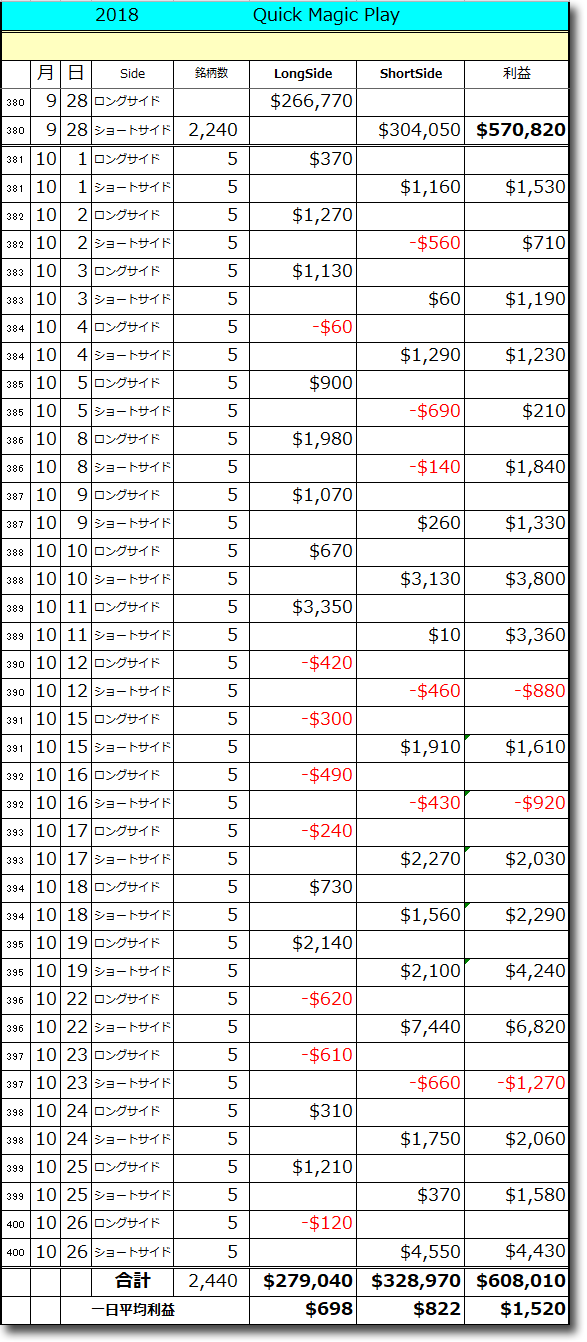
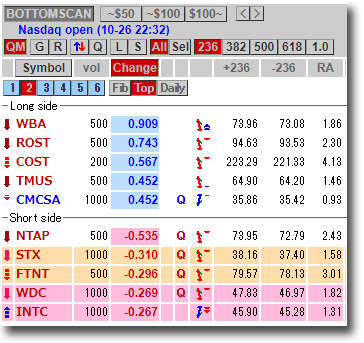
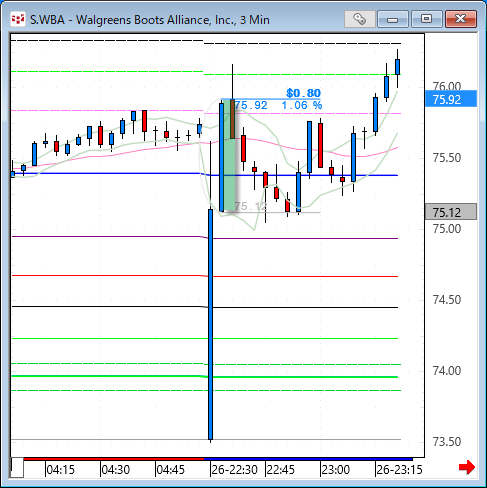
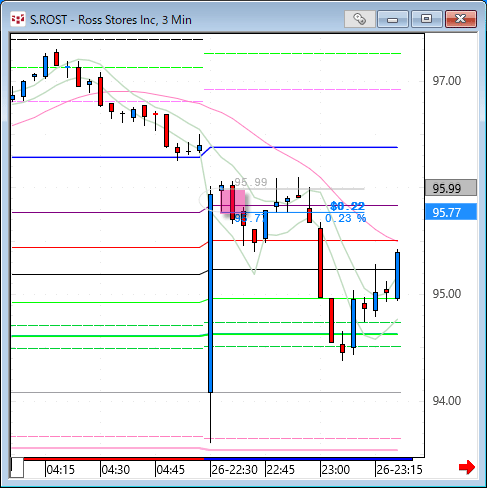
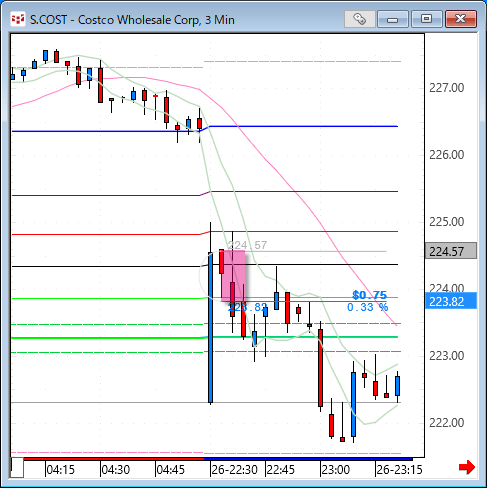
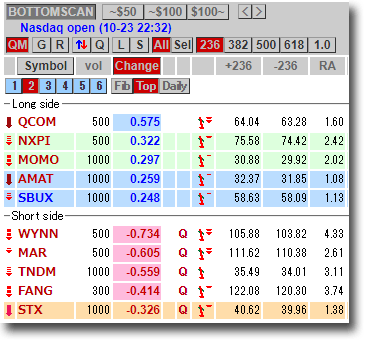
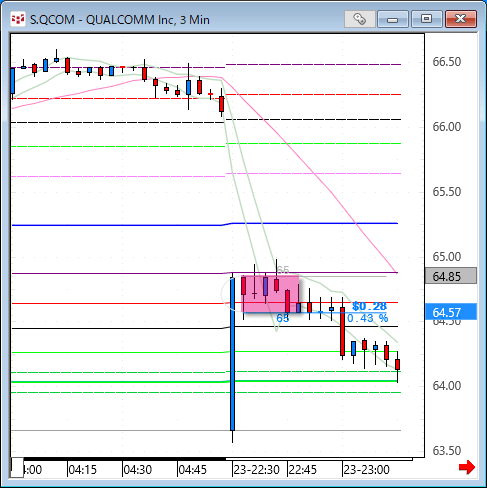
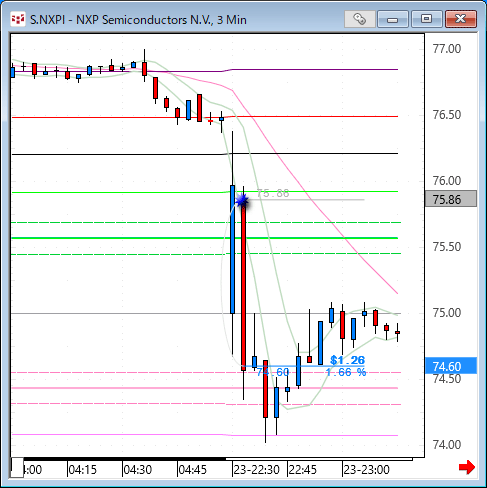
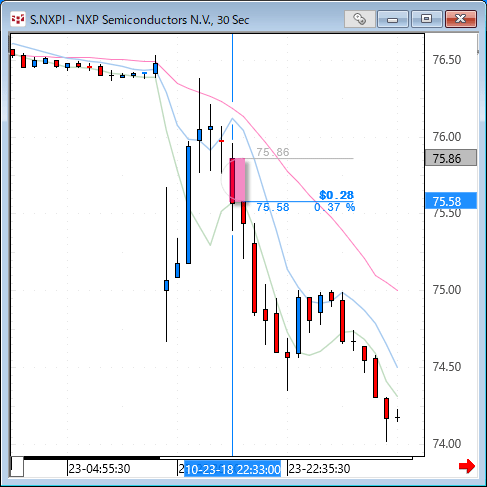
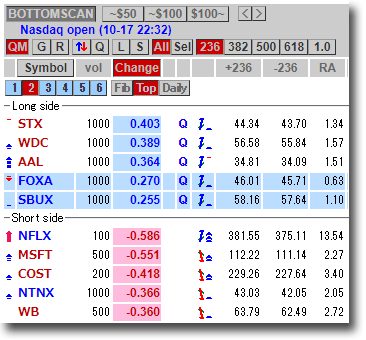
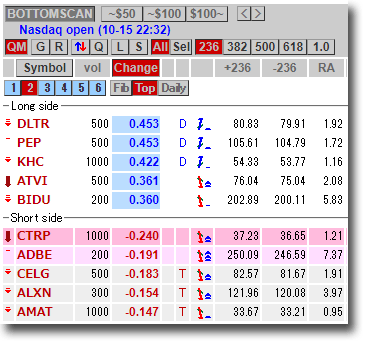
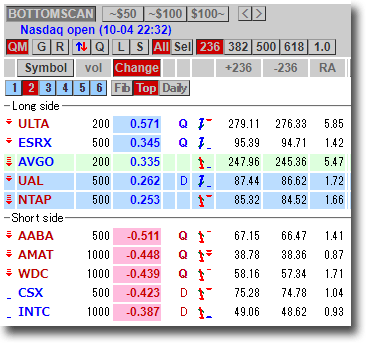
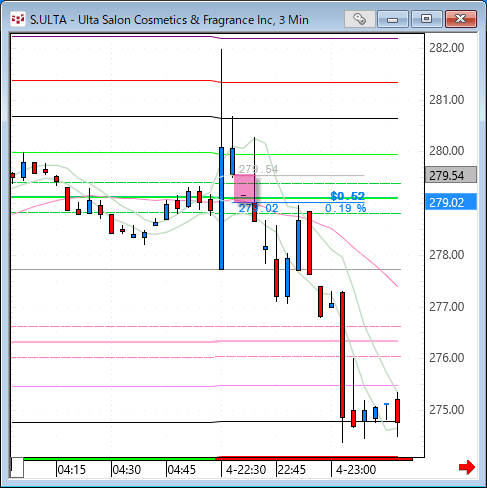
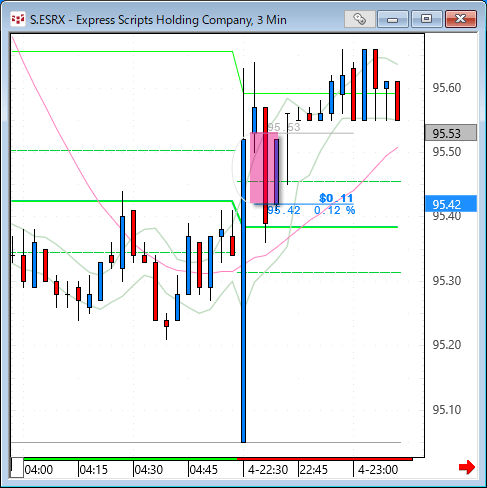
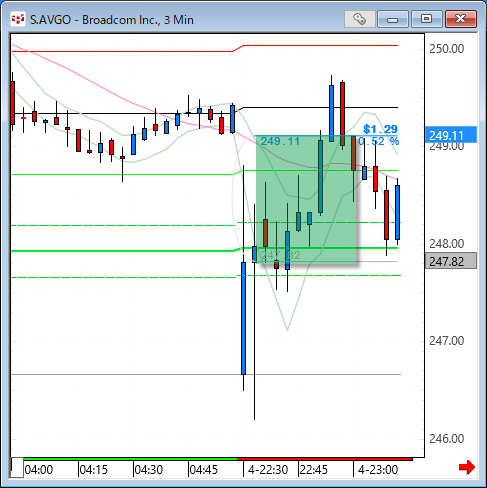
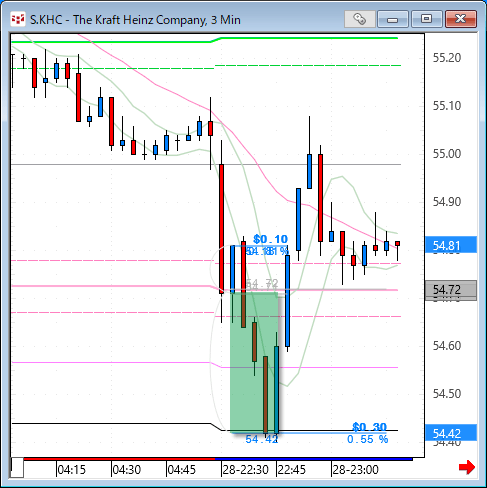
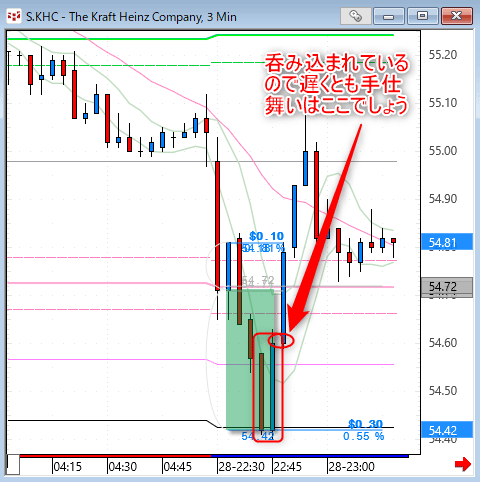
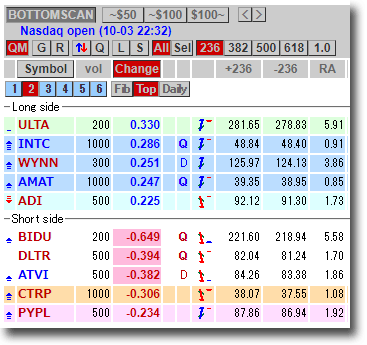
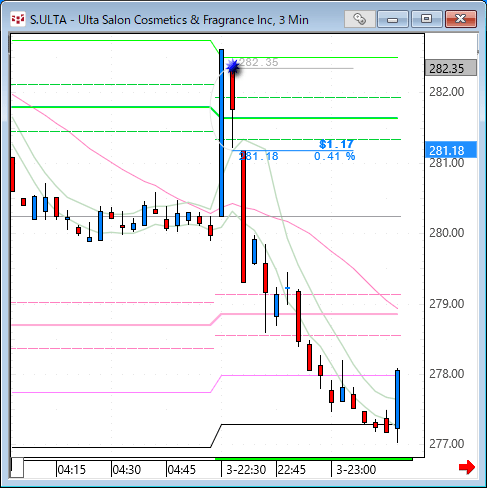
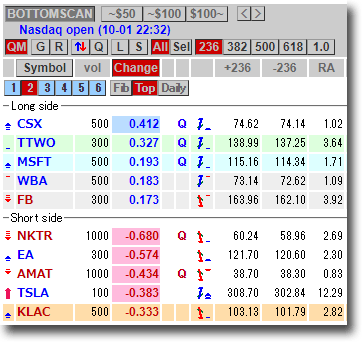
NMNは無事到着で触れた、ニコチンアミド・モノヌクレオチドですが、どのように効くのか?
について、関連する詳しい解説を見つけました。
下記に全文をテキスト化してあります。
画像などは下記のリンク先にある本文を参照してください。
細胞死を引き起こすイオンチャネル 原雄二
活性酸素などによる酸化ストレスが加わることで、カルシウムイオン濃度の均衡を破綻させ最終的に細胞死を引き起こすイオンチャネルが存在することが明らかになった。
このチャネルの発見は深刻化の一途をたどる癌やエイズ、アルツハイマー病などの病態を改善する薬剤開発につながる可能性を秘めており、熱い視線が注がれている。
胞内外で厳密に制御されているイオン濃度
私たちの生体は、寒冷や化学物質、細菌、ウイルス、精神的緊張といった、さまざまな種類のストレスにさらされている。
そのようなストレスに満ちた日常の中で何事もなく生活できるのは、生体内の多様な防御機構のおかげである。
生体の防御機構というと免疫が思い浮かぶが、細胞内外のイオン浪度の厳密な制御もまた生体防御機構の一つである。
真核生物の細胞は、ナトリウムイオンや塩索イオン、カルシウムイオンを多く含む細胞外液に浸された環境に置かれている。
それに対し通前の細胞内において、これらのイオンは細胞外棗校が変化しても一定の浪度に保たれるようになっている。
これは、細胞が細胞膜の脂質二重層に存在するイオンチャネルやトランスポーターを使って、ナトリウムイオン、塩索イオン、カルシウムイオンなどの浪1文を厳密にコントロールしているからである。
細胞膜に存在するイオンチャネルは、いくつかのサブユニットタンパク質から構成され、一つの細胞の膜上には何万というオーダーのイオンチャネルが存在する。
その形状は脂質二重層を貰通する中空のポア(孔)のようであり、文字どおり、細胞の内と外をつなぐ通り逍(チャネル)になっている。
イオンチャネルは必要にに応じて開いたり閉じたりしており、この開閉調節はゲーティングとよばれる。
イオンチャネルごとに「どの種のイオンを通すかが決まっており、あるものはほぼ一 種類のイオ ンのみを通過させ、またあるものは何種類ものイオンを通貨させる。
一般的には、そのチャネルが何のイオンを通しやすいかによって、ナトリウムチャネル、カリウムチャネル、カルシウムチャネルなどとよばれている。
こうしたチャネルのゲー テ ィ ングはさまざまな刺激(シグナル)により調節されている。
その中で、膜電位の変化がシグナルとなるものは電位依存性チャネル、神経伝達物質などの細胞外リガンドがシグナルになるものはリガンド依存性チャネルとよばれる。
ほかに 、 イノシトール三 リ ン酸やサイクリックヌクレオチドなどの細胞内シグナル伝逹分子によって活性化されるチャネルもある。
イオン濃度制御の破綻が引き起こす細胞死
こうしたイオンチャネルによる細胞内イオン濃度の制御は、生体に過剰なストレスが加わることによって細胞内に活性酸索種が急増すると破綻してしまうことが知られている。
さまざまな内囚あるいは外因によって生じる活性酸素種を、休体内に存在する抗酸化物質が処理しきれなくなり、細胞内酸化還元状態を維持できなくなるためである。
活性酸素種とは、過酸化水索やスーパーオキシドアニ オン、ヒドロキシラジカルなどのように、通常の分子状の酸素に比べて 、 たいへん反応性の高い分子種の総称である。
いずれもきわめて高い毒性をもち、核陵やタンパク質、脂牧などの生体構成分子を傷つけることで、最終的に細胞死をもたらす。
細胞死は 、 細胞みずからが能動的に死を引き起こすアポトーシスと、 外的要因によって細胞が破壊されるネクローシスに区別されている。
アポトーシスで は、細胞内の核の染色休凝集、核の断片化、細胞質の凝縮などの形態変化がみられる。
細胞は萎縮して、内容物が細胞外に放出lされることなくマクロファージな どに取り込まれる。
一方のネクローシスは、火傷やけがといった細胞の置かれた環境悪化により引き起こされる。
この場合はひどい炎症がおき 、 細胞の内容物が放出されて死に至る。
活性酸素種は、アポトーシスとネク ローシスの両者を引き起こすことがわかってきている。
活性酸索種を発生させるようなストレスをまとめて酸化ストレスとよぷが、酸化ストレスは、がんやエイズ、アルツハイマー病、 動脈硬化、 老化などに密接に関与している。
活性酸索稲は核内のDNAに傷をつけたり、タンパク質を変性させることによって 、臓器や組織中の異常な細胞堺殖や細胞死を引き起こす。
では 、具体的にどのよ う な イオ ンの制御不全が、どのようにして細胞傷害や細胞死を引き起こすのだろうか。
すでに述べたように、細胞内外のイオン濃度は厳密に調節されている。
調節因子となるのは、細胞外からの刺激(シグナル)である。
細胞内外のイオン濃度は 、シグナルに応じて劇的に変化する。
そのようなシグナルのセカンドメッセンジャーと して きわめて重要であると考えられている物質に、カルシウムイオンがある。
カルシウムイオンは、静止状態における細胞内では100nM程度の濃度に保たれている。
細胞内のカルシウムイオンは外界からの刺激などによって濃度変化が引き起こされ、それが筋肉収縮、神経伝達物質の放出、シグナル伝達、細胞分化、細胞周期制御などの引き金になることが知られている。
しかし 、カルシウムイオンが細胞内に急激に流入すると 、さ まざ まな情報伝達のカスケードが過剰に活性化されることにより、細胞死が誘発される。
細胞死に関わるイオンチャネルの同定
以上の経緯を踏まえ 、私たちは細胞外からのカルシウムイオン流人を担うイオンチャネルに着目し 、特に細胞の生存と死に深く関与するイオンチャネルの同定を試みた。
カルシウムチャネルは当初 、細胞外からのカルシウムイオンの流入経路としての電位依存性カルシウムチャネルとリガンド依存性カルシウムチャネルが知られていた。
しかし、生理的に重要なカルシウム流入経路はこれらだけにとどまらなかった。
特に最近は 、Gタ ンパク質共役型受容体などの活性化により作動する受容体活性化チャネルが、 新たなカルシウムイオン流入経路として注目を集めている。
私たちも 、候補分子を探索するにあた って 、受容体活性化カルシウムチャネル群として知られるTransient eceptor Potencial 遺伝子群(Trp)に着目した。
Trpはショウジョウパエの光受容器異常の原因遺伝子として同定され 、後の研究によ って、遺伝子産物であるTRPタンパク質がカルシウムイオン透過製のチャネルであることが明らかになったものである。
現在では 、哺乳類のTRP類似遺伝子が多数発見されている。
このファミリーには 、多発性嚢胞腎の原因であるPKO (Polycystic Kidney Disease)遺伝子や 、細胞外の浸透圧の変化によ り活性化されるOTRPC4追伝子 、トウガラシの辛み成分であるカプサイシン受容体で、痛覚刺激に関与する と考えられているVanilloid受容体の遺伝子などが存在する。
いずれのTRP類似遺伝子も 、さまざまな刺激に反応して細胞内にカルシウムイオンなどを透過することで、生体内において重要な役割を果たしているものと考えられている。
私たちが酸化ストレスに反応するチャネルをTRPファミリ ー から探索した理由も、そこにある。
このようなTRPファミリ ー に関する遺伝子の一 つに、ヒトゲノムプロジェクトの一 役で発見されたLTRPC2遺伝子があった。
私たちはまず、 この遺伝子をデータベースで検索し、遺伝子産物のタンパク質(アミノ酸レペル)で13%の相同性をもつショウジョウバエ(Drosophila)のLTRP C2遺伝子のcDNAライプラリーを作成した。
そこからcDNAクローニングによってターゲットの遺伝子を分離することに成功し、マウスの生体内で遺伝子を発現させてみた。その結果、脳、肺、牌臓、目においてLTRPC2遺伝子のmRNAが発現していることが、ノーザンプロッティングによって確認された。
このことは、脳や肺などにおいてLTRPC2からなるチ ャネル(LTRPC2チャネル)が発現していたことを示している。
次に、LTRPC2チャネルをヒトの胚腎細胞へ組替え発現させ、 酸化ストレスを加えた時の細胞内カルシウムイオンの濃度測定を行った。
その際、酸化ストレスのモデル系として 、過酸化水素用いた。
過酸化水索は酸索分子が2電子分還元された状態のもので、酸素毒の代表ともいえる化合物である。
生体内においては、ある濃度まではペルオキシダーゼやカタラーゼなどによって処理される。
一方で過酸化水素には、 白血球内で殺菌のために利用されたり 、甲状腺ホルモンの合成に用いられるという側面もある。
LTRPC2チャネルを発現させた細胞では、 きわめて低浪度の過酸化水索によ って、 細胞膜を越える急激なカルシウムイオンの流人が引き起こされた。
これほどの低濃度の過酸化水素で活性化されるカルシウムイオンチャネルの存在は、これまで知られていなかった。
一方で、 LTRPC2チャネルを発現していない細胞では、 そのような流入は起きなかった。
LTRPC2チャネルが活性化されるしくみ
過酸化水索はどのようにして、 LTRPC2チャネルを活性化したのであろうか?
私たちは、イオンチャネルの機能を直接測定できる電気生理学解析を試みることにした。
イオンチャネルの中をイオンが透過することにより生じる電流を測定してみたのである。
その際、細胞内の分子がピペット内に漏出することを防ぐために、 細胞膜に小孔を開ける試薬をピペット内に加えておいた。
そのうえでLTRPC2チャネルを発現させた細胞に過酸化水索を加えて測定してみると、大きな電流が観察された。
しかし、ピペット内に細胞内小分子が漏出するような通常の方法では、この電流は観察されなかった。
この結果は、何らかの細胞内小分子がLTRPC2チャネルの活性化に関与していることを示唆している。
そしてβニコチンアミドアデニンヂヌクレオチド(β -NAD+)こそが、LTRPC2の活性化に関与する分子であったことを突き止めた。
NADは微生物から蒻等生物までが広くもつ物質で、生体内の分了間、あるいは分子内の酸化還元反応を担っている。
NADにはa、α、βの立体異性体が存在し、β型は補酵索としてのはたらきをもっている。
実際に、今回の実験において、β-NAD十 が過酸化水素を加えることによって一時的に上昇することが確認できたことから、 β-NAD + が過酸化水索によるLTRPC2チャネルの活性化に介在しているのは確かであると思われる。
さらに直接ビベット内にβ-NAD + を加えて電流を測定したところ、LTRPC2チャネルを発現させた細胞では大きな内向き電流が見られた。
しかし、β-NAD+ はどのよ う に してLTRPC2に作用しているのであろうか?
LTRPC2タンパク質のカルポキシル末端には、MutTモチー フとよばれるヌクレオチド結合モチーフが存在する。
細胞に、MutTモチ ー フ を欠失したLTRPC2を発現させて調べた結朱、MutTモチ ー フがチ ャネル活性に必須であることが明らかになった。
さらなる生化学的、電気牛理学的解析により、β-NAD十 が直接M utT モチ ーフに作用することも明らかになった。
細胞死に関与するLTRPC2チャネルの活性化
こうした一連の研究により、私たちは、 LTRPC2チャネルが酸化ストレスによって活性化されることを証明することができた。
しかし、さらなる謎が生まれた。
LTRPC2チャネルの泊性化が細胞死をもたらすのかどうか、 ということである。
実験では、LTRPC2チャネルを強制的に発現させた細胞に過酸化水索を加えると、細胞の内容物が外に吹き出すような形態が観察された。
また、細胞の生存数をトリパンプルー 染色法により数えてみると、LTRPC2チャネル発現細胞では生存数が明らかに減少していた。
これらの結果は、LTRPC2チャネル発現細胞において、比較的低浪度の過酸化水素によって細胞ク協が引き起こされたことを示唆するものとなった。
そこで次に、内在的にLTRPC2チャネルを発現している細胞を用いて検討を行ってみた。
アンチセンス核酸法を用いて、内在的に発現しているLTRPC2チャネルの機能抑制を試みたのである。
追伝子から転写されたmRNA、あるいはmRNAからタンパク質へ翻訳されるためのtRNAは、ともに一本鎖である。
アンチセンス核酸法は、 こうした 本鎖領域に結合する核酸を設計し導入することで、遺伝子の材能発現を抑制する方法である。
LTRPC2チャネルを発現している細胞としては、がん化インスリン分泌細胞株であるRIN-5Fを用いた。
このRIN-5FにLTRPC2特異的なアンチセンス核酸を導入し、活性酸素種を加えてみた。
アンチセンス核酸を導入していないコントロール細胞においては、活性酸索種を加えることにより 、 細胞内カルシウムイオン度の上昇と細胞死が引き起こされた。
しかしアンチセンス核像導人細胞では、コントロー ル細胞に比べて、有意に細胞内カルシウムイオン濃炭の上昇と細胞死が抑制された。
これまでの実験系では細胞外から過酸化水素を加えてきたので、ミトコンドリアなどの細胞内から発生する活性酸索種でもLTRPC2チャネルが祈性化されるのかどうかを確認してみる必要があった。
私たちは、腫瘍壊死因子 (TNFα)によって産生される活性酸素種によって 、LTRPC2チャネルが活性化される可能性を検討してみることにした。
というのは、 TNFaは細胞表而の特沢的な受容体に結合し、さまざまな経路により細胞l障害をもたらすことが知られており、その一つとして、ミトコンドリアなどから活性酸索稲を過刺に放出させることがわかっているからである。
実際RIN-5FにTNFαを加えたところ、細胞内カルシウム濃度上昇が確認され、細胞化が引き起こされていることも確認された。
ここでもLTRPC2チャネルの発視最を抑制するために、LTRPC2アンチセンス核酸を導入したところ、細胞内力ルシウム濃度および細胞死は有意に抑制された。
さらに単球細胞株であるU937細胞においても同様の実験を行い、過酸化水索とTNFα添加による細胞死が抑制されることを確かめた。
このことからLTRPC2はさまざまな細胞株で、細胞死の誘導に働きうることが明らかになった。
以卜のような一連の研究によりLTRPC2は細胞内の酸化返元状態の破綻により活性化されるチャネルであること、そして細胞死をもたらす分子のひとつであることが、それぞれ明らかにされた。
このような研究は、単に学術的な成果としてだけではなく 、医学分野に大きく貢献する可能性を秘めたものであるといえる。
今後は、 LTRPC2チャネルの選択的な阻害剤の探索などにより、酸化ストレスが関与するさまざまな病態の改善に結ぴつく薬剤開発が期待される。